Troć wędrowna (Salmo trutta m. trutta)
Niegdyś troć nie była wyróżniana jako osobny gatunek, a określana jako łosoś, ze względu na duże do niego podobieństwo. Jako osobny gatunek została opisana w 1780 roku przez Kluka i nazwana łosiopstrągiem. W późniejszych publikacjach można natknąć się na nazwę łośpstrąg, jednakże ostateczną formę – troć zaproponował w 1864 roku Wałecki, która do dzisiaj funkcjonuje (Brylińska 2000, Cios 2007, 2008).
Status gatunku w Polsce:
- Gatunek użytkowy. Poławiany przez rybaków zawodowych i wędkarzy. Gatunek hodowlany.
- Wymiar ochronny: 35 cm na wodach śródlądowych , 50 cm na Wodach Morskich
- Liczba ryb w połowach przemysłowych – nielimitowana.
- Liczba ryb w połowach wędkarskich – 2 szt. w ciągu doby
Okresy ochronne:
W rzece Wiśle i jej dopływach powyżej zapory we Włocławku:
- Od dnia 1 października do 31 grudnia; w pozostałym okresie obowiązuje zakaz połowu w czwartki, piątki, soboty i niedziele.
Na odcinku rzeki Wisły od zapory we Włocławku do jej ujścia:
- Od dnia 1 grudnia do końca lutego; w okresie od 1 marca do 31 sierpnia obowiązuje zakaz połowu w piątki, soboty i niedziele.
W innych wodach śródlądowych:
- Od 1 dnia 1 października do 31 grudnia
W cztero-milowym pasie wód przybrzeżnych w polskich obszarach morskich (za wyjątkiem terytorium podlegającemu Okręgowemu Inspektoratowi Rybołówstwa Morskiego w Gdyni):
- Od 15 września do 15 listopada
Kategorie zagrożenia:
- Według IUCN (Miedzynarodowej Rady ochrony Przyrody) – LC (niższego ryzyka)
- Według Czerwonej listy minogów i ryb (Witkowski i.in.) – CD (zależne od ochrony)
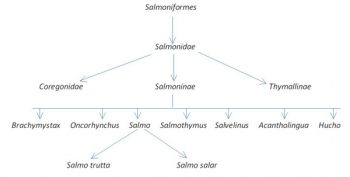
Droga rozwoju łososiowatych (filogeneza)
Przodkowie rodziny łososiowatych pojawili się najprawdopodobniej w okresie kredy ok 63 – 130 mln lat temu (Legendre, 1980) i według niektórych autorów zasiedlali wyłącznie słodkowodne środowisko (Bagliniere 1999 za Tchemavin 1939). Podrodzina Salmoninae zaczęła ewoluować i wykształcać poszczególne taksony w trzeciorzędzie (Legendre, 1980), głownie w miocenie, podczas gdy w morzach panował największy ze znanych rekinów Megalodon (Carcharodon megalodon) przodek żarłacza białego. Spowodowane zmianami ruchu płyt kontynentalnych warunki klimatyczne doprowadziły do izolacji poszczególnych linii Salmoninae i wykształcenia w plejstocenie dzisiaj znanych rodzajów Salmo, Oncorhynchus czy Slavelinus (Rys. 1). Wykształcenie się nowych kontynentów skutkowało nie tylko specjacją allopatryczną poszczególnych taksonów, ale także wymusiło niejako zmianę cyklu życiowego. Według Bagliniere 1999 za Tchemavin 1939 część łososiowatych zaczęła prowadzić anadromiczny tryb życia. Niemniej Balon (1980) uważa, że diadromiczny tryb życia pojawił się u Salmonidae jeszcze przed specjacją i został ewolucyjnie utracony, by ponownie pojawić się podczas zlodowaceń. Obecne zachowania i behawior łososiowatych, w tym Salmo trutta, ostatecznie ukształtował się około 10 000 lat temu (Lelek 1980).
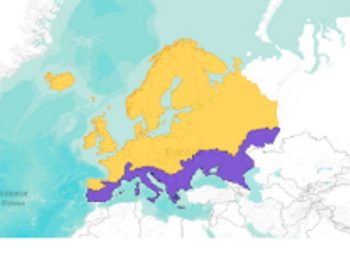
Zasięg występowania
Troć występuje w rzekach i wodach morskich wschodniej części północnego Atlantyku. Południową granice występowania wyznaczają północne rzeki Portugalii, przez wybrzeża Zatoki Biskajskiej, Morza Północnego i Bałtyku. Najdalej na Północ zasięg występowania sięga Morza Białego, wybrzeża Skandynawii. Granicę zachodnią wyznacza Islandia i wyspy Faroer (Brylińska 2000 za Berg 1948a) (Rys. 2). Szacuje się, że w zlewni samego Bałtyku istnieje około 1000 rzek, do których troć wędrowna wpływa na tarło (ICES 2011a,b).
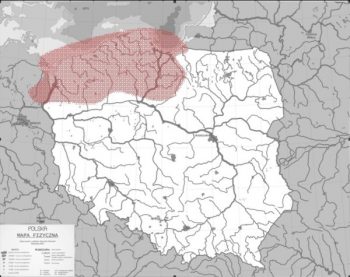
W Polsce troć, podobnie jak łosoś, niegdyś licznie występowała w dorzeczu górnej Wisły i Odry, jednak zabudowa hydrotechniczna (w tym 1968 zapory we Włocławku), degradacja naturalnych siedlisk i zanieczyszczenia uniemożliwiły wędrówki rozrodcze tej anadromicznej ryby, zarówno w południowe tereny Polskich rzek, ale również części cieków Pomorza. Obecnie spotyka się w Wiśle i jej dopływach poniżej zapory tj. Drwęcy, Wierzycy czy Wdzie. W dorzeczu Odry występuje w Inie, Warcie, Drawie oraz Gwdzie (Rys. 3) oraz rzekach Pomorskich.
Liczebność populacji jest trudna do oszacowania ponieważ mimo programów monitorujących wędrówki ryb anadromicznych nadal istnieje problem ze zwrotem identyfikatorów, którymi zostały oznaczone grupy ryb. Poleganie wyłącznie na raportach połowowych jest również niepewne i nie pozwala dokładnie ocenić kondycji populacji wybranych gatunków (różnice wynikające z aktywności połowowej na skutek warunków pogodowych czy zaniechania działalności). Niemniej dzięki danym gromadzonym przez instytucje państwowe, jest możliwe określenie choćby w przybliżeniu kierunku trendów liczebności i struktury wiekowej wybranych ryb (Rys. 4).

Cechy taksonomiczne
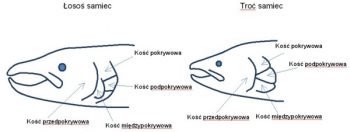
Pod względem morfologii troć wędrowna podobna jest do łososia. Jest jednak bardziej od niego krępa, walcowata, lekko bocznie spłaszczona. Jej głowa jest dość duża, przy czym u samców jest ona stosukowo większa, samice mają bardziej smukłą głowę – jednak nie w tak znacznym stopniu jak u łososia. Stosunki te mogą ulegać pewnym zmianom zależnie od płci, wieku i wielkości ryby, a także warunków środowiskowych. Charakterystyczny jest układ kości wieczka skrzelowego odróżniający ją od łososia (Rys. 5). Kość podokrywowa nie styka się na całej długości z kością przedpokrywową u łososia, natomiast u troci kość pokrywowa, międzypokrywowa i przedpokrywowa maja jedno wspólne miejsce kontaktu z kością pokrywową. Inna również jest budowa blaszki lemiesza, bowiem u troci jest trójkątna uzębiona (2 – 6 zębów) , natomiast u łososia pięciokątna nieuzębiona.
Kość górnoszczękowa często sięga za tylną krawędzi oka. W okresie tarłowym u samców w dolnej szczęce wyrasta lekko zakrzywiony hak, który nie jest tak mocno wykształcony i zakrzywiony do tyłu jak u łososia. Trzon ogona przechodzący troci jest znacznie szerszy niż u łososia, natomiast płetwa ogonowa u osobników starszych prosta, a młodocianych lekko wcięta (Rys. 6). Kolejną cechą odróżniająca troć jest liczba łusek liczona od linii nabocznej do płetwy tłuszczowej i wynosi 14 – 19, gdy u łososia od 11 do 15 (Brylińska 2000). U ryb hodowlanych często jest bark płetwy tłuszczowej (rodzaj znakowania bez uszczerbku dla zdrowia ryb) oraz mogą występować anomalie anatomiczne zwłaszcza płetw piersiowych.

Ubarwienie młodocianych form troci wędrownych jest bardzo zbliżone do pstrąga potokowego, przez co rozróżnienie taksonów nastręcza wielu kłopotów. Zależnie od warunków środowiskowych panujących w rzece kolor ciała przybiera różne odcienie brązu. Boki ciała są pokryte czarnymi i czerwonymi plamkami, a u stadiów młodocianych widać wyraźne ciemne plamy narybkowe (9-14)(Brylińska 2000, Chełkowski 1970, Kirczuk i Domagała 2003), ciemniejsze niż u pstrąga potokowego. Czarne plamki występują także na głowie, płetwie tłuszczowej i grzbietowej. Wraz z upływem czasu, w okresie późnowiosennym, następuje u poszczególnych osobników zmiana ubarwienia na srebrne. Pozbawione charakterystycznego ubarwienia dwuletnie smolty spływają do morza. Osobniki dorosłe mają powłoki ciała perłowo srebrzyste, z wyraźnie ciemniejszym grzbietem – zazwyczaj o srebrzysto zielonym lub srebrzysto oliwkowym odcieniu. Na bokach występują ciemne plamy zarówno nad, jak i pod linią naboczną. W okresie przedtarłowym ubarwienie zmienia się na ciemniejsze, brązowe, brązowo szare w partiach brzusznych, szczególnie u samców, dodatkowo mogą pojawić się jaśniejsze plamy (Brylińska 2000). Po odbytym tarle kelty troci, ponownie wysrebrzają się. Na bokach ciała występują zazwyczaj dość licznie czarne plamy, w kształcie mniej lub bardziej rozlanych, czy rozmazanych iksów. Mogą one występować na całym ciele zarówno nad, jak i pod linią boczną. Na głowie występują tylko nieliczne okrągłe lub owalne czarne plamy, najbardziej skupione na pokrywach kości skrzelowych.
Biologia
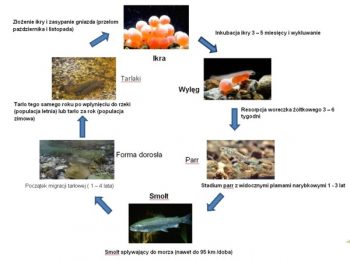
Jak u typowej ryby dwuśrodowiskowej u troci wędrownej można wyróżnić w cyklu życiowym dwa główne etapy. Pierwszy związany jest ze środowiskiem słodkowodnym, drugi z morzem oraz wędrówką tarłową.
Złożenie ikry w gnieździe i jej zapłodnienie zapoczątkowuje długi i niebezpieczny okres przemian, którym poddana zostanie troć wędrowna nim wróci na tarło do rzeki. Jaja podlegające podziałom są niezwykle wrażliwe na zmiany środowiskowe, jak spadki poziomu tlenu, czy zanieczyszczenia, z drugiej jednak strony wykazują pewną tolerancję przystosowawczą i mechaniczną odporność na czynniki zewnętrzne. W wyniku długoletnich obserwacji okazało się, że osłonki jajowe ryb łososiowatych charakteryzują się wyjątkowo wysoką wytrzymałością, a w przypadku troci wynosi 2 – 3 kg (Sobociński i in. 2005). Po około czteromiesięcznym okresie inkubacji, zależnie od temperatury wody, następuje wylęg (luty – marzec), zaopatrzony w duży woreczek żółtkowy, z którego zapasów larwa będzie korzystać do momentu zresorbowania jego ¾ objętości. Wówczas zaczyna podejmować próby samodzielnego pływania, jednak ze względu na prądy wodne część larw zostaje zniesiona w niższe partie rzeki, co pozwala rozrzedzić obsadę gniazda, tym samym zabezpieczyć bazę pokarmową dla innych osobników oraz zapobiec zbytniej presji potencjalnych drapieżców (ikra, wylęg i mały narybek stanowią doskonałe źródło pokarmu nie tylko dla innych ryb, ale także larw owadów, dużych skorupiaków, czy żab). Po 3 – 6 tygodniach od wylęgu w pełni ukształtowana larwa troci zaczyna aktywnie zdobywać swój pierwszy pokarm, który stanowią małe formy skorupiaków, fauny dennej, larw owadów, czyli makrobezkręgowce, będące podstawowym pokarmem juwenilnych łososiowatych (Klemetsen i inni 2003). W miarę wzrostu rozmiarów ciała zaczyna odżywiać coraz bardziej urozmaiconym i większym pokarmem. Narybkowe stadium parr jest jednym z kluczowych etapów dla istnienia populacji troci wędrownej, bowiem w tym okresie nabiera cech i zachowań biologicznych decydujących o powodzeniu w dalszych etapach życia (Amundsen i Gabler 2008, Pilecka-Rapacz i in. 2011). W tym czasie również bardzo intensywnie żeruje, a dobowe przyrosty w półrocznym okresie pobierania pokarmu, mogą sięgać 3% masy ciała (Amundsen i in. 2001, Czerniawski i in. 2010a, b). Etap wzrostu troci wędrownej w rzece może trwać od roku do nawet 7 lat, jednak w Polsce najczęściej wędrówka ku morzu zaczyna się w drugim roku życia, poprzedzona zmianą ubarwienia ciała tzw. smoltyfikacji. Migracji towarzyszy wiele zmian na poziomie fizjologicznym, morfologicznym i behawioralnym zachodzących w ciele ryby (Folmar i Dickhoff 1980), na które główny wpływ mają czynniki środowiskowe jak fotoperiod i temperatura (Björnsson i Bradley 2007). Przed procesem wysrebrzania gromadzone są puryny, w szczególności guanina i hipoksantyna w łuskach i powierzchniowych warstwach skórnych (Hayashi 1970). To właśnie puryny odpowiedzialne są za srebrne zabarwienie łusek. Pod względem zmian zachowań obserwowano utratę, bądź zmniejszenie terytorializmu, zmianę nawyków żywieniowych, opuszczenie kryjówek i miejsca żerowania, a także tendencje do gromadzenia się w grupy oraz co ciekawe, ograniczenie aktywności pływania (Wankowski 1977), która wynikać może ze zmian fizjologicznych. Zmiana warunków środowiskowych, na hiperosmotyczne w stosunku do zawartości płynów ustrojowych ryby wymaga znacznego nakładu energii, co generuje wysoki poziom stresu. Na szczęście dla troci wody Bałtyku maja zbliżony poziom zawartości jonów do stanu fizjologicznego tj. około 0,7 %. Niemniej za prawidłową wymianę jonów nie powodującą zaburzeń stanu zdrowotnego ryby odpowiadają bogate w mitochondria komórki solne zlokalizowane w skrzelach i nabłonku wyścielającym kości operculum, a także oraz nabłonek jelita i nerka tułowiowa (związane jest to z aktywnością ATP-azy, co za tym idzie pompą sodowo – potasową) (Maetz i Bomancin 1975, Kamacky i in. 1977). Ich praca polega na niedopuszczeniu do odwodnienia organizmu poprzez wypływ wody na zewnątrz ciała, w celu wyrównania równowagi osmotycznej. Oczywiście całość procesów regulacyjnych jest związana również ze sterowaniem endokrynnym. Jedna z wcześniejszych teorii głosiła że to właśnie trójjodotyroksyna odgrywa główną rolę w procesie wymiany jonów i jest jednym z czynników warunkujących prawidłowy przebieg smoltyfikacji (Folmar i Dickhoff 1980), jednak w świetle późniejszych badań wykazano, że faktycznie ma wpływ na wymianę jonową, ale nie wykazuje większego wpływu na migrację ryb anadromicznych do morza (Ojima i Iwata 2007). Niemniej należy przyjąć, że zjawisko jest niezwykle złożone, wieloczynnikowe i nie można wykluczyć wpływu hormonów tarczycy na wędrówkę, tym bardziej, że podanie w paszy, czy nawet bezpośrednie iniekcje bez uwzględnienia wszystkich czynników środowiskowych i fizjologicznych nie dają pełnego i pewnego obrazu zjawiska. Jednak po wielu dramatycznych, dla organizmu troci, przemianach jako smolt wpływa do morza (z pewnymi wyjątkami – istnieją osobniki, które całe życie jako forma dojrzała spędzają w rzece ubarwione jak stadium parr tzw. samce satelitarne, podobne zjawisko występuje u łososia). Wówczas następuje gwałtowne przyspieszenie wzrostu. Główny pokarm troci wędrownej stanowią Cluepidae (Skóra i in. 1998) oraz jako uzupełnienie diety Ammodytidae, co wskazuje na żerowanie w strefie przybrzeżnej. Według Bartla (1987a) trocie z rzek pomorskich oraz Wisły odbywały dalekie wędrówki i były poławiane u wybrzeży Szwecji. Czas i odległość na jaka wędrują trocie zależy po części od warunków środowiskowych, jak i zachowań sterowanych genetycznie (Kallio – Nyberg i in. 2002). Niemniej wydaje się, że umiejętność dostosowania się do odpowiedniego ekosystemu i umiejętność znalezienia wystarczającej, dla populacji, bazy pokarmowej często determinują podejmowanie przez ryby dalszych wędrówek. Okres życia w morzu trwa od roku do czterech lat. W tym czasie osobniki troci wędrownej zwiększają swoje rozmiary z 15 – 25 cm, jako smolt, do 60 – 80 cm i kilku kilogramów wagi. Dorosłe ryby zaczynają kierować się ku rzekom, w których się urodziły, to zjawisko nosi nazwę „home instinct”, bądź „homing”. Dzikie populacje troci wędrownej w większości docierają do macierzystych cieków, jednak ze względu na zanieczyszczenia wszelkiego rodzaju (chemiczne, fizyczne), zdarza się, że poszczególne osobniki były poławiane w sąsiednich rzekach (Dębowski i Bartel 1995). W przypadku populacji pochodzących z zarybień sprawa się dużo bardziej komplikuje. Prowadzona w nonszalancki sposób gospodarka rybacka polegająca na wprowadzaniu nieautochtonicznego materiału do wód spowodowała wymieszanie puli genowych poszczególnych populacji (Kangur i Wahlberg 2001, Kwiatkowski 2003). Wówczas, przyjmując tezę o współzależności kierunku migracji od puli genowej i warunków środowiska, zależnie od ekspresji poszczególnych genów, wybrane osobniki mogą kierować się w zupełnie odległe miejsca od tych, w których zostały wpuszczone. Sygnałem do rozpoczęcia migracji i koncentracji tarłowej jest zmiana długości dnia tzw. fotoperiod oraz temperatury (Svendsen i in. 2004). W Polsce występują dwa ciągi rozrodowe letni i jesienny, w których uczestniczą trocie różne pod względem ubarwienia i stopnia rozwoju gonad (Borzęcka 2010). Podczas pierwszego ryby zaczynają wędrówkę w górę rzeki już w czerwcu. Mają zaczątki szaty godowej i powiększone gonady. Wraz z ze spadkiem temperatury coraz wyraźniej zmienia się ubarwienie, a gruczoły płciowe wielokrotnie powiększają swoja objętość (nawet do 18 % masy ciała). Ryby przystępują do tarła w tym samym roku, w którym wpłynęły do rzeki. Zazwyczaj pierwsze na tarliskach pojawiają się samce, a dopiero później dołączają do nich samice. Ma to niebagatelne znaczenie w przypadku kontrolowanego rozrodu. Co prawda samce wcześniej dojrzewają i dłużej oddają produkty płciowe, niemniej w okresie przetrzymywania, najczęściej w rozmaitej konstrukcji klatkach, obserwuje się bardzo wysoką śmiertelność. Po zgromadzeniu odpowiedniej ilości samic może okazać się, że dysponujemy zaledwie kilkoma zdrowymi samcami, a pula genetyczna pobranych produktów płciowych jest zbyt mała do zapewnienia odpowiednio wysokiej zmienności populacji. Rozwiązaniem wydaje się zastosowanie technik kriokonserwacji nasienia, które z powodzeniem można przechowywać przez wiele lat, bez większego uszczerbku dla jakości plemników. Zimowy ciąg tarłowy populacji troci wędrownej ma miejsce wczesną jesienią, a pierwsze osobniki pojawiają się w estuariowych odcinkach rzek we wrześniu. Nasilenie tego zjawiska obserwowane jest w listopadzie i trwa do stycznia, a nawet do marca. Wstępująca troć posiada srebrne ubarwienie i całkowicie nierozwinięte gonady, które zwiększają swoja objętość w trakcie migracji. Pierwsze ryby budujące gniazda można zaobserwować już we wrześniu, jednak w większości tarło odbywa się w październiku, listopadzie, w zależności od warunków środowiskowych, gdy temperatura wody spadnie poniżej 8°C. Dorosłe osobniki wybierają miejsca o podłożu żwirowatym i/lub kamienisto żwirowatym o szybkim, ale stałym prądzie wodnym (0,5 – 1,5 ms-1) (Tański i in. 2011). Samice budujące gniazdo, gwałtownymi ruchami ogona wykopują zagłębienie o długości około 1,5 m (choć zdarzają się mniejsze, ale przyjmuje się, że zakres wielkości trociowych gniazd wynosi od 1 do 2 m) i głębokości kilkunastu, kilkudziesięciu centymetrów. Wówczas następuje akt tarła, gdzie samica składa ikrę (około 1500 jaj na kg masy ciała samicy), a towarzyszące jej samce (zazwyczaj od 1 do 3) zaplemniają ikrę. Następnie samica zakopuje gniazdo tworząc charakterystyczny kopczyk z okalającym go jaśniejszym wypłukanym piaskiem i mniejszym żwirem, po czym odpływa. Samce pozostają w pobliżu gniazd, aby wziąć udział w tarle z innymi samicami. Niestety ze względu na małą ilość dostępnych miejsc tarłowych część gniazd może ulec zniszczeniu lub zasypaniu, wówczas rozwijająca się ikra ma małe szanse na przeżycie. Z wcześniejszych obserwacji wynika, że część populacji troci wraca na tarło kilkukrotnie (nawet do 10%), jednak obecnie, mimo starań wielu organizacji związanych z rzekami, ichtiologów i zaangażowania lokalnej społeczności, wydaje się wątpliwe aby osiągnąć tak wysoki poziom „zwrotów”.
Choroby (wybrane)
W ostatnich latach obserwuje się niepokojące zjawisko występowania u licznych osobników troci wędrownej owrzodzeń i pleśniawki (Rys. 8). Ogromny wysiłek oraz zmiana środowiska towarzysząca migracji tarłowej stanowią niewątpliwy czynnik stresowy powodujący obniżenie odporności, co powoduje, że ryby są poddane działaniu wielu patogenów i tym samym bardziej wrażliwe (Rys. 9).
Istnieje zatem możliwość, przy masowej skali tego zjawiska, znaczna redukcja osobników przystępujących do tarła i związane z tym bezpośrednie niebezpieczeństwo minimalizacji sukcesu tarłowego. Dlatego ważne jest rozpoznanie etiologii poszczególnych zespołów chorobowych by w przyszłości można im zapobiegać. W warunkach naturalnych występują epidemie dziesiątkujące ryby, jednak w dużej mierze to człowiek i zmiany środowiskowe, które poczynił, są głównym źródłem i powodem występowania opisanego powyżej zjawiska. Rola selekcji naturalnej, którą przez nierozważne postępowanie, zaburzyliśmy, została zepchnięta na margines. Zarybienia nie zrekompensują wszystkich szkód wyrządzonych rzekom. Obecnie dzięki wielu instytucjom, stowarzyszeniom i wolontariuszom przy współpracy z ichtiologami, ciekom przywraca się ich naturalny charakter, powiększa powierzchnię rozrodową i odrostową dla ryb, co pozwala mieć nadzieję, że już niedługo będziemy mogli obserwować we wszystkich rzekach wędrówki tarłowe nie tylko troci wędrownej, ale także łososia, jesiotra, certy, siei czy parposza.
| Nazwa choroby | Nazwa patogenu | Rodzaj patogenu | Objawy | Leczenie |
| Furunkuloza | Aeromonas salmonicida | Bakteria | Szare odbarwienia najczęściej występujące na wieczku skrzelowym pod oczami i na pysku, przekształcające się we wrzody. Następnie w miejscach chorobowo zmienionych rozwijają się drożdże oraz grzyby. W niektórych przypadkach opanowują całe ciało. | Antybiotykoterapia. Podawanie antybiotyków razem z paszą. |
| BKD – bakteryjna choroba nerek | Renibacterium salmoninarium | Bakteria | Pociemnienie powłok zewnętrznych wysadzenie gałek ocznych bladość skrzeli, powiększenie jamy brzusznej, wybroczyny u nasady płetw i przy odbycie błony wokół narządów wewnętrznych, głównie nerek ogniska martwicze w śledzionie, wątrobie i sercu niekiedy ogniska martwicze w mięśniach nadosiowych, przechodzące w duże ubytki, zwane kawernami | Antybiotykoterapia. Podawanie antybiotyków razem z paszą. |
| Jersinoza | Yersinia ruckerii | Bakteria | Zaczerwienienie jamy gębowej i gardła (przekrwienie), wybroczyny w jamie gębowej, w gardle oraz u nasady płetw, wylewy krwawe w gałce ocznej, ogniskowe przekrwienie powłok zewnętrznych, martwicze ubytki mięśni, pociemnienie skóry, niekiedy wysadzenie gałek ocznych | Antybiotykoterapia. Podawanie antybiotyków razem z paszą. |
| Wirusowa posocznica krwotoczna* | VHS | Wirus | Pociemnienie powłok, wysadzenie gałek ocznych i wylewy krwawe w gałce ocznej, ruchy spiralne, gwałtowne zrywy, obrzęk ciała, anemia skrzeli, wybroczyny u nasady płetw. | Brak |
| Zakaźna martwica układu krwiotwórczego* | IHN | Wirus | Wysadzenie gałek ocznych, Pociemnienie skóry, obrzęk przedniej części jamy ciała wychudzenie, anemia skrzeli pseudoodchody w postaci długich ciągnących się przezroczystych nitek | Brak |
Dodatek specjalny.
Rozsądne i zrównoważone korzystanie z zasobów przyrodniczych pozwoli nam, ludziom, smakować różnych smaków natury, przez wiele stuleci, bez ryzyka utraty różnorodności biologicznej.
Przykłady wykorzystania kulinarnego troci
W zasadzie obowiązują te same przepisy kulinarne, które wykorzystuje się dla przygotowania potraw z łososia. Kupić bałtycką troć na rynku, czy na przystani rybackiej jest łatwiej niż dzikiego łososia (porównaj informacje dot. wielkości połowów). Od niemal każdego rybaka (a najlepiej od jego żony) można uzyskać ciekawy przepis na przygotowanie dania z tej wyśmienitej ryby. Poniżej podajemy tylko kilka przykładów z Internetu.
Kolor tkanki mięsnej troci może być różny i zależy o składników, które stanowiły podstawę jej pokarmu. Czym ryba jadła więcej skorupiaków lub polowała na owady tym barwa jej mięsa będzie bardziej czerwona. Barwa wewnętrznej części filetów troci jedzącej śledzie i szproty jest od lekko kremowego do lekko różowego.
- Troć marynowana w pierzu i koprze. [http://www.kuchniaplus.pl/przepisy/przepisy-kulinarne-kuchni-plus/troc-marynowana-w-pieprzu-i-w-koprze_5571.html]
- Troć pod szlachetnym sosem [http://kuchnia.o2.pl/przepisy/troc-pod-szlachetnym-sosem-o_1510]
- Troć pieczona w soli:
[http://polki.pl/kuchnia_przepisy_lista_dania_glowne_artykul,10025728.html] - Zupę z troci przygotowuje się tak samo ja jak z łososia, ale są i receptury spcjalnie dedykowane temu gatunkowi [http://scrumptiousandsumptuous.com/2013/05/15/fish-trout-soup/]
Opracowanie:
Maciej Kwiatkowski, Wojciech Górski, Krzysztof E. Skóra
Literatura:
Amundsen P.-A., Gabler H.-M., Riise L.S. 2001. Intraspecific food resource partitioning in Atlantic salmon (Salmo salar) parr in a subarctic river. Aquat. Living. Resour., 14, 257–265.
Amundsen P.A., Gabler H.M. 2008. Food consumption and growth of Atlantic salmon parr in subarctic rivers: empirical support for food limitation and competition. J. Fish Biol., 73, 250–261
Bagliniere J.L., Maisse G. 1999. Biology and Ecology of the Brown and Sea Trout. Praxis Publishing Ltd, Chichester, UK, 1999.
Balon E. K., 1980. Early ontogeny of the lake charr, Salvelinus (Cristivomer) namaycush.
Björnsson B.T., Bradley T.M. 2007. Epilogue: Past successes, present misconceptions and future milestones in salmon smoltification research. Aquacult. 273, s. 384 – 391.
Borzęcka I. 2010. Classifying Vistula and Pomeranian sea trout populations using discriminant functions based on selected scale characters. Arch. Pol. Fish. (2010) 18: 123-131.
Cios S. 2007. Ryby w życiu Polaków od X do XIX w. Wyd. IRŚ Olsztyn.
Cios S. 2008. Jest problem, czy go nie ma? Czy troć już wyparła pstrąga?. Prz. Ryb. 2008 R. 33 nr 5 s. 42-45
Chełkowski Z., 1970. Morphological charakteristics of trout (Salmo trutta L.) pomeranian rivers. Acta. Ichthyol.
Czerniawski R., Pilecka-Rapacz M., Domagała J. 2010a. Growth and survival of brown trout fry (Salmo trutta m. fario L.) in the wild, reared in the hatchery on different feed, EJPAU 13(2), http://www.ejpau.media.pl
Czerniawski R., Domagała J., Pilecka-Rapacz M. 2010b. Wstępne wyniki wpływu podchowu wylęgu troci (Salmo trutta m. trutta l. 1758) na żywym zooplanktonie na przeżywalność i wzrost w warunkach naturalnych. Rocz. Nauk. PZW., 23: 131–139.
Dębowski P., Bartel R.. 1995: Homing of tagged sea trout (Salmo trutta L.) smolts released into Polish rivers. Arch.Ryb.Pol. 3:107-122.
Folmar, L.C., Dickhoff, W.W. 1980. The parr-smolt transformation (smoltification) and seawter adaptation in salmonids. A review of selected literature. Aquaculture, 21: l-37
Freyhof, J. 2013. Salmo trutta. The IUCN Red List of Threatened Species. Version 2014
Hayashi, S., 1970. Biochemical studies on the skin of fish. II. Seasonal changes of purine content of masu salmon from parr to smolt. Bull. Jpn. Sot. Sci. Fish., 37: 508-512. In Charrs E. K. Balon (Ed), Junk, The Hague, 485-562.
ICES (2011a). Report of the Baltic Salmon and Trout Assessment Working Group (WGBAST), 22–30 March 2011, Riga, Latvia. ICES 2011/ACOM:08. 297 pp.
ICES (2011b). Report of the ICES Advisory Committee. ICES Advice. Book 8, 135 pp.
Kallio – Nyberg I., Saura A., Ahlfors P. 2002. Sea migration pattern of two Sea trout (Salmo trutta) stocks released into the Gulf of Finland. Ann. Zol. Fennici 39: 221 – 235.
Kangur M., Wahlberg B. 2001. Present and potential production of salmon in Estonian rivers. Genetic characterization of Estonian salmon populations. Estonian Academy Publishers, Tallin.
Karnacky Jr., K.J., Degnan K.J., Zadunaisky J.A. 1977. Chloride transport across isolated opercular epithelium of killifish: a membrane rich in chloride cells. Science,195: 203-205.
Kirczuk L., Domagała J. 2003. Characteristisc of young sea trout (Salmo trutta m. trutta L., 1758) growing in Pomeranian rivers to the smolt stage. Elect. Jour. of Pol. Agricul. Univ. Fish. Vol. 6, I. Piscat. 1, 43-57.
Klemetsen A., Amundsen P.-A., Dempson B., Jonsson B., Jonsson N., O’Connell M.F., Mortensen E. 2003. Atlantic salmon Salmo salar L., brown trout Salmo trutta L. and Arctic charr Salvelinus alpinus (L.), a review of aspects of their life histories. Ecol. Fresh. Fish, 12, 1–59.
Kwiatkowski M. 2003. Identyfikacja osobników łososia (Salmo salar), troci wędrownej (Salmo trutta m. trutta) oraz ich hybrydów F1 na podstawie mikrosatelitarnego DNA. Praca magisterska wykonana na Wydziale Ochrony Środowiska i Rybactwa Uniwersytetu Warmińsko – Mazurskiego, Olsztyn 2003.
Lelek A., 1980. Les poissons d’eau douce menaces en Europe. Conseil de l’Europe,Strasbourg. Sauvegarde laNature, Vol. 18,277 pp.
Maetz, J. and Bornancin, M., 1975. Biochemical and biophysical aspects of salt excretion by chloride cell in teleosts. Fortschr. Zool. 23: 322-362.
Nelson J. S., 1994. Fishes of the World, 3rd edn. John Wiley, New York, 600 pp.
Ojima D., Iwata M., 2007. The relationship between thyroxine surge and onset of downstream migration in chum salmon Oncorhynchus keta fry. Aquacult. 273, 185–193
Pilecka-Rapacz M., Domagała J., Czerniawski R. 2011. Dieta stadium parr troci wędrownej (Salmo trutta trutta) na tle warunków pokarmowych trzech niewielkich leśnych cieków. Rocz. Nauk. PZW 2011, t. 24, s. 133-146
Ryby słodkowodne Polski. 2000. Praca pod red. M. Brylińskiej. PWN Warszawa 2000.
Skóra K.E., Haluch M., Pelczarski W., Zaporowski R. 1998. Efekty zarybiania Zatoki Puckiej. Skład pokarmowy ryb łososiowatych. Opracowanie wykonane dla Fundacji Rozwoju Uniwersytetu Gdańskiego na zlecenie Urzędu Morskiego w Gdyni 1998.
Sobociński A., Biernaczyk M., Szulc J., Formicki K., Winnicki A. 2005. Zmiany wytrzymałości osłonek jajowych troci (Salmo trutta m. trutta L. ) z kilku rzek polskiego wybrzeża w wieloleciu. W: Rozród, podchów, profilaktyka ryb sumokształtnych i innych gatunków. Pod red. Zdzisława Zakęsia. Olsztyn: Wydaw. IRS 2005 s. 171-174, il. +bibliogr. 5 poz.
Svendsen J.C., Koed A., Aarestrup K. 2004. Factors influencing the spawning migration of female anadromous brown trout. Journ. of Fish Biol. (2004) 64, 528–540
Tański A., Wasiuk Ł., Szulc J., Korzelecka – Orkisz A., Formicki K. 2011. Ilość gniazd tarłowych troci wędrownej (Salmo trutta m. trutta) w rzece Gowienica w latach 2009 – 2010. Ocena i ochrona bioróżnorodności wód. Praca zbiorowa pod red. M. Jankun, G. Furgała – Selezniow, M. Woźniak, A.M. Wisniewskiej. Str. 91 – 99, Olsztyn 2011.
Tchernavin V., 1939. The origin of Salmon. Salmon Trout Mag., 95,120-140.
Wankowski J.W.J. 1977. The role of prey size in the feeding behavior and growth of juvenile Atlantic salmon. Ph.D. Thesis, Univ. Sterling, Sterling, Scotland, 212 pp
Witkowski A., Kotusz J., Przybylski M. 2009. Stopień zagrożenia słodkowodnej ichtiofauny Polski: Czerwona lista minogów i ryb – stan 2009. Chrońmy Przyr. Ojcz. 65 (1): 33–52.


